
产品货号:
YTB1019
中文名称:
细菌内毒素检测试剂盒(鲎试剂显色法改良型)
英文名称:
Improved Chromogenic LAL Endotoxin Assay Kit
产品规格:
400T
发货周期:
1~3天
产品价格:
询价

本试剂盒基于鲎试剂酶促反应原理,专门用于细菌内毒素(endotoxin)的定量检测,具有超高灵敏度、高稳定性、强抗干扰能力等特点。检测灵敏度可以低达0.01EU/mL,并且可以检测微量样品,样品的体积可以仅为10μL或更小体积。
本试剂盒检测时间短,样品需求量小。检测试剂加入到待测样品中最快16分钟左右,即可完成显色反应,从而实现简单、快速、高灵敏地检测内毒素含量;不依赖凝固蛋白形成凝胶,抗干扰能力强,可适用于本底颜色为淡黄色的样品,如血浆、血清等;对待测样品消耗量小,每个反应体系仅需使用10μL待测样品;含有偶氮化试剂,检测灵敏度高、测定样品的线性范围宽,检测内毒素浓度范围为0.01~1.00EU/mL,并且可避免有色检品自身颜色对检测的干扰。

鲎试剂为鲎科动物东方鲎的血液变形细胞裂解物的冷冻干燥品或体外重组的同类试剂,鲎试剂中含有C因子、B因子、凝固酶原、凝固蛋白原等。在适宜的条件下(温度,pH值及无干扰物质),内毒素激活C因子,引起一系列酶促反应,激活凝固酶原形成凝固酶,凝固酶分解本试剂盒中提供的显色剂,使其分解为多肽和黄色的对硝基苯胺(λmax=405nm)。在一定时间内,pNA的生成量与内毒素浓度成正相关。同时,对硝基苯胺(pNA)也可与偶氮化试剂反应生成玫瑰红色产物(λmax=545nm),据此可以定量待测样品的内毒素浓度,并可避免待测样品本身的颜色对405nm处吸收峰的干扰。

- 溶液样品中内毒素污染检测;
- 各种不同类型样品中内毒素含量的定量检测。

| 组分 | 规格 |
| 内毒素标准品(10EU) | 1支 |
| 内毒素检测试剂 | 1瓶 |
| 内毒素检测试剂配制液 | 3mL |
| 显色剂 | 1管 |
| Buffer A(100×) | 200μL |
| Buffer B | 1管 |
| Buffer C | 20mL |
| 内毒素检测用水 | 120mL |
保存:2~8℃,有效期1年。

本试剂盒置于-20℃,可以保存更长时间。显色剂和Buffer C须避光保存。内毒素检测试剂溶解后须立即适当分装,-20℃保存一周有效,经液氮速冻后-80℃保存至少两个月有效。其余试剂溶解后-20℃保存,至少6个月有效。

- 内毒素检测试剂溶解后很不稳定,需要尽量在10分钟内使用完毕或适当分装后保存。因此试剂盒在使用过程中需要预先做好各项准备工作,在需要加入内毒素检测试剂前再溶解内毒素检测试剂,或解冻之前分装冻存的内毒素检测试剂。
- 本试剂盒中的内毒素检测试剂溶解后,须立即适当分装,-20℃保存一周有效,经液氮速冻后-80℃保存至少两个月有效。务必避免反复冻融。
- 本制品所提供的内毒素检测用水请在首次开启后建议立即使用完毕,或务必在无内毒素实验条件下,使用无内毒素实验耗材对其适当分装并保存于-20℃。常规实验室条件下,反复多次取用同一容器中的内毒素检测用水,极易因环境因素造成内毒素的污染。
- 请务必使用首次开启的内毒素检测用水或分装后确保无内毒素污染的内毒素检测用水,或自行准备的确保无内毒素的超纯水进行内毒素检测所需试剂的溶解和配制,以免造成试剂的外源内毒素污染。
- 所有内毒素检测的实验过程均需在无内毒素条件下,使用无内毒素实验耗材进行,否则极易对内毒素检测造成干扰。
- 实验所用的器皿需经预处理,以去除可能存在的外源性内毒素,常用的方法是在250℃干烤至少60分钟,也可以采用其它确保不干扰细菌内毒素检查的适宜方法。若使用塑料器械,应选用表明无内毒素并且对实验无干扰的器械。
- 实验操作过程应防止微生物的污染。
- 本试剂盒提供的内毒素标准品含量是根据内毒素标准品效价进行确定的,在使用前请务必注意查看并仔细确认内毒素标准品含量。
- 本制品所提供的内毒素标准品为刻痕型安瓿瓶(有预制刻痕及色点标记)包装,内毒素检测试剂及内毒素检测试剂配制液均为西林瓶包装,开启时需参考使用说明步骤规范操作,以免试剂污染、玻璃碎屑混入或手部划伤。
- 溶解并稀释后的内毒素标准品溶液静置时间若超过10分钟,使用前应在旋涡振荡器上振荡混匀1分钟。冻存的溶解后的内毒素标准品,下次使用时须先充分溶解,并剧烈涡旋混合后使用。
- 内毒素检测所需试剂在溶解配制好后,如不能一次性使用完,请立即使用无内毒素的耗材进行分装冻存,随用随取。
- 同一管检测试剂在常规实验条件下多次反复取用后,也极易造成环境中内毒素的污染,建议根据实验需求对试剂进行适当分装。
- 推荐设置不添加待测样品的空白对照,以确认整个检测体系是否被环境内毒素所污染。
- 样品的稀释和制备,推荐使用本试剂盒提供的内毒素检测用水或无菌无内毒素超纯水。

- 以下所有实验操作均须在无内毒素条件下进行,推荐使用GoldBalb系列无菌吸头,锥形离心管,1.5mL离心管或PCR管等实验耗材进行体外内毒素含量的检测。
- 待测样品的预处理及注意事项:
- 待测样品与内毒素检测试剂混合后溶液的pH值应在6~8之间,若超出此范围,需用不含内毒素的缓冲液、0.1M氢氧化钠或0.1M盐酸调节pH。
- 若待测样品中可能存在鲎试剂检测的干扰物质,处理方法参见本使用说明第4点“待测样品的干扰实验”。
- 若待测样品中可能含有β-葡聚糖(β-葡聚糖会产生G因子旁路反应,干扰内毒素检测),需选用特异性内毒素检测试剂。
- 若待测样品为一些抗菌素如头孢类抗菌素和磺胺制剂会干扰显色反应。
- 若待测样品的本底吸光度值大于0.5,必须对待测样品适当稀释后再检测。
- 请务必使用首次开启的内毒素检测用水或分装后确保无内毒素污染的内毒素检测用水,或者自行准备确保无内毒素的超纯水进行待测样品的稀释,以免干扰内毒素检测结果。
- 若待测样品颜色较深(例如溶血),或在酸性条件下颜色加深(例如一些组织培养介质)必须设置待测样品空白管以扣除待测样品自身的颜色本底。
- 待测样品空白管不加入内毒素检测试剂,以等体积溶剂(该处为内毒素检测用水)代替。其余操作同待测样品管。
- 接触检测试剂及待测样品的所有器皿必须是无内毒素的。
- 如需使用玻璃器皿,可经250℃干烤至少60分钟以去除内毒素后再进行使用。
- 待测样品与内毒素检测试剂混合后溶液的pH值应在6~8之间,若超出此范围,需用不含内毒素的缓冲液、0.1M氢氧化钠或0.1M盐酸调节pH。
- 实验操作:
- 内毒素标准品溶液的准备。
- 安瓿瓶的开启:本制品中所提供的内毒素标准品为刻痕型安瓿瓶(有预制刻痕及色点标记)包装,已预制刻痕,开启时通常无需用砂轮再次划刻;但若断口玻璃残渣较多或开启吃力,也可用安瓿砂轮在刻痕处打磨一圈,以便更易掰开且使断口更平整。推荐可参考如下步骤规范在戴乳胶手套的情况下开启安瓿瓶:
- 如果顶部有粉末可以轻轻敲击安瓿瓶颈部(细长部分)数次使粉末坠落,以保证颈部无试剂粉末残留,并防止开启时粉末流失或飞溅;
- 使用75%的乙醇棉签(球/片)从安瓿瓶口(试剂端)向颈部(刻痕处)单向擦拭消毒,避免来回擦拭造成污染;
- 消毒后待乙醇自然挥发(约10~15秒),期间不可用手或其它物品触碰消毒区域;
- 一手拇指顶住安瓿色点侧的颈部(刻痕上方),其余四指托住安瓿底部(试剂端),固定安瓿瓶垂直状态,另一手拇指、食指轻轻捏住安瓿非色点侧的颈部(刻痕下方),向远离色点的方向(即“向外掰”)缓慢发力,使安瓿瓶沿刻痕处整齐折断,以避免用力过猛导致玻璃碎屑及试剂飞溅,也可用纱布包裹瓶颈防割伤;
- 开启后,应立即观察瓶内是否有玻璃碎屑(可轻轻倾斜安瓿瓶,借助光线查看);同时检查瓶口断面是否平整,若有残留玻璃渣,需用无菌棉签轻轻拭去(不可触碰瓶口内侧,避免试剂污染);
- 在溶解过程中可以吸取液体轻轻润洗安瓿瓶壁以完全溶解粉末,若安瓿瓶上端细长部分有明显粉末,也可以进行润洗并吸取。
- 如果顶部有粉末可以轻轻敲击安瓿瓶颈部(细长部分)数次使粉末坠落,以保证颈部无试剂粉末残留,并防止开启时粉末流失或飞溅;
- 内毒素标准品溶液的配制:标准曲线所采用的内毒素浓度可以为0.010、0.025、0.050、0.075、0.100EU/mL或0.10、0.25、0.50、0.75、1.00EU/mL等,请根据待测样品内毒素含量,选择配制相应范围的内毒素标准品溶液并绘制标准曲线。稀释方法如下:取试剂盒提供的内毒素标准品1支(10EU),确认内毒素标准品粉末在安瓿瓶底部,如果顶部有粉末可以轻轻敲击安瓿瓶颈部,使粉末坠落;按照上述步骤规范开启安瓿瓶后,加入1mL内毒素检测用水,静置约半分钟,反复抽吸数次后转移到一无内毒素1.5mL离心管内;放置于旋涡混匀器上振荡2~3分钟以充分溶解并混匀内毒素标准品。将上述配制好的10EU/mL内毒素标准品溶液进一步用内毒素检测用水逐步稀释为0.1EU/mL和1.0EU/mL的内毒素溶液。随后以0.1EU/mL内毒素标准品溶液为母液按照下表依次稀释成浓度为0.01、0.025、0.05、0.075、0.10EU/mL的内毒素标准品溶液。或以1.0EU/mL内毒素标准品溶液为母液按照下表依次稀释成浓度为0.10、0.25、0.50、0.75、1.00EU/mL的内毒素标准品溶液。
内毒素浓度(EU/mL) 内毒素检测用水(μL) 0.1EU/mL内毒素溶液(μL) 0.100 0 100 0.075 25 75 0.050 50 50 0.025 75 25 0.010 90 10 内毒素浓度(EU/mL) 内毒素检测用水(μL) 1EU/mL内毒素溶液(μL) 1.00 0 100 0.75 25 75 0.50 50 50 0.25 75 25 0.10 90 10 - 每稀释一步均应在旋涡振荡器上剧烈振荡至少20秒。
- 若稀释好的内毒素溶液静置时间超过10分钟,需在旋涡混匀器上剧烈振荡1分钟以充分混匀后使用。
- 配制好的低浓度内毒素标准品溶液应在4小时内用完。
- 为确保稀释的准确性,每一步稀释的稀释倍数不得超过10倍。
- 请务必使用首次开启的内毒素检测用水或分装后确保无内毒素污染的内毒素检测用水,或者使用自行准备的确保无内毒素的超纯水进行内毒素标准品溶液的配制,以免造成外源内毒素的污染,干扰检测结果。
- 建议将配制好的内毒素标准品溶液使用无内毒素的耗材进行分装保存,以免反复多次使用后被外源内毒素污染。
- 内毒素标准品溶液建议现配现用;也可分装冻存于-20℃,随用随取,至少6个月有效。
- 通常建议使用同一批次的内毒素标准品(或国家计量院提供的内毒素标准品)与内毒素检测相关试剂进行内毒素含量检测,以免因不同批次间内毒素标准品溶液配制方式及浓度偏差影响检测准确性;如果确实需要将不同批次的内毒素标准品与内毒素检测相关试剂交叉使用,建议先对不同批次内毒素标准品进行标准曲线的绘制,明确标准品效价的一致性,再进行待测样品的内毒素含量检测。
- 安瓿瓶的开启:本制品中所提供的内毒素标准品为刻痕型安瓿瓶(有预制刻痕及色点标记)包装,已预制刻痕,开启时通常无需用砂轮再次划刻;但若断口玻璃残渣较多或开启吃力,也可用安瓿砂轮在刻痕处打磨一圈,以便更易掰开且使断口更平整。推荐可参考如下步骤规范在戴乳胶手套的情况下开启安瓿瓶:
- 阴性对照为内毒素检测用水。
- 内毒素检测试剂的溶解。
- 西林瓶的开启:本制品所提供的内毒素检测试剂及内毒素检测试剂配制液均为西林瓶包装。推荐可参考如下步骤规范在戴乳胶手套的情况下开启西林瓶:
- 如果密封盖或瓶身有粉末/液体,可以轻轻敲击西林瓶身数次使粉末/液体坠落,以保证试剂尽可能沉落至瓶底,并防止开启时试剂流失或飞溅;
- 使用75%的乙醇棉签(球/片)对铝塑组合盖进行单向擦拭消毒,避免来回擦拭造成污染;
- 消毒后待乙醇自然挥发(约10~15秒),期间不可用手或其它物品触碰消毒区域;
- 先轻轻掰下或旋下顶部的塑料铝盖保护帽,露出铝制金属盖;
- 用无菌镊子或专用开瓶器(避免用手直接接触),沿铝盖边缘轻轻撬动,去除整个铝盖(注意避免铝屑掉入胶塞缝隙);
- 再次用75%的乙醇棉签(球/片)擦拭暴露的胶塞表面,确保无菌并待乙醇自然挥发(约10~15秒);
- 开启橡胶塞时请将瓶身直立,一手稳固握住瓶身,一手用无菌镊子捏住橡胶塞边缘部分,向上向外打开,并请避免直接接触橡胶塞内侧及瓶口,以免造成试剂污染;
- 在内毒素检测试剂溶解过程中可以吸取液体轻轻润洗西林瓶内壁以完全溶解粉末,若西林瓶橡胶塞内侧有明显粉末,也可以进行润洗并吸取。
- 如果密封盖或瓶身有粉末/液体,可以轻轻敲击西林瓶身数次使粉末/液体坠落,以保证试剂尽可能沉落至瓶底,并防止开启时试剂流失或飞溅;
- 内毒素检测试剂的溶解:按照上述步骤规范开启西林瓶后,在试剂盒提供的内毒素检测试剂瓶内加入2mL内毒素检测试剂配制液,轻轻混匀使其完全溶解,静置20秒后使用。
- 不可进行涡旋混合等方式激烈振荡,以避免检测试剂失活。
- 溶解好的内毒素检测试剂溶液应尽量在10分钟内用完,否则可能会影响检测效果。
- 如果溶解好的内毒素检测试剂溶液不会一次性全部用完,须立即使用无内毒素的耗材进行适当分装,-20度保存一周有效,-80度保存至少两个月有效。经液氮速冻后-80℃保存效果更佳。务必避免反复冻融。
- 请务必使用首次开启的内毒素检测试剂配制液进行内毒素检测试剂的溶解,溶解后立即使用或在无内毒素实验条件下分装冻存,以免造成外源内毒素的污染,干扰检测结果。
- 内毒素检测试剂溶液在分装后,不宜反复多次取用同一管,否则极易造成环境内毒素的污染。因此,请根据实验所需,对内毒素检测试剂溶液进行适当分装后冻存,随用随取。
- 西林瓶的开启:本制品所提供的内毒素检测试剂及内毒素检测试剂配制液均为西林瓶包装。推荐可参考如下步骤规范在戴乳胶手套的情况下开启西林瓶:
- 显色剂的溶解。先加入1mL内毒素检测用水至显色剂瓶中,轻轻混匀使显色剂完全溶解。然后全部转移至15mL离心管内,再加入3mL内毒素检测用水,即共配制成4mL显色剂溶液。
- 显色剂溶液在无污染的条件下于4℃避光保存一周内有效,-20℃避光保存至少半年有效。
- 请务必使用首次开启的内毒素检测用水或分装后确保无内毒素污染的内毒素检测用水,或使用自行准备的确保无内毒素的超纯水进行显色剂的溶解和配制,以免造成环境内毒素的污染,干扰检测结果。
- 如果溶解好的显色剂溶液不会一次性全部用完,可以立即使用无内毒素的耗材进行适当分装,以免反复多次使用后造成外源内毒素的污染和干扰。
- 显色剂溶液在分装后,不宜反复多次取用同一管,否则极易造成环境内毒素的污染。因此,请根据实验所需,对显色剂溶液进行适当分装后冻存,随用随取。
- 显色剂在溶解过程中可以吸取液体轻轻润洗瓶壁以完全溶解粉末,若盖子内侧有明显粉末,也可以进行润洗并吸取。
- Buffer A、B的溶解。
- 参照下表配制反应终止液。通常37%的浓盐酸其摩尔浓度即为12M。
内毒素检测用水(ml) 12M HCl(mL) 反应终止液(mL) 20 0.8 20.8 - Buffer A:加20mL反应终止液至Buffer A (100×)中,充分混匀。
- Buffer B:加20mL内毒素检测用水至Buffer B中,充分溶解并混匀。
- Buffer A和B溶液,4℃保存一周内有效,-20℃保存至少半年有效。
- 请务必使用首次开启的内毒素检测用水或分装后确保无内毒素污染的内毒素检测用水,或使用自行准备的确保无内毒素的超纯水进行Buffer A和B的溶解和配制,以免造成外源内毒素的污染,干扰检测结果。
- 如果Buffer A、B、C溶液不会一次性全部用完,可以立即使用无内毒素的耗材进行适当分装,以免反复多次使用后造成外源内毒素的污染和干扰。
- Buffer A、B、C溶液在分装后,不宜反复多次取用同一管,否则极易造成环境内毒素的污染。因此,请根据实验所需,对Buffer A、B、C溶液进行适当分装后冻存,随用随取。
- Buffer C溶液在长时间储存或多次冻融后,可能会出现溶液变黄的现象,但并不影响内毒素的检测效果,可继续使用。
- 参照下表配制反应终止液。通常37%的浓盐酸其摩尔浓度即为12M。
- 待测样品内毒素含量检测参照下表进行。具体操作步骤如下:
试剂 阴性对照 内毒素标准品 待测样品 内毒素检测用水(μL) 10 内毒素标准品溶液(μL) 10 待测样品(μL) 10 内毒素检测试剂溶液(μL) 5 5 5 混匀,37℃孵育T1分钟。 显色剂溶液(μL) 10 10 10 混匀,37℃孵育T2分钟。 Buffer A溶液(μL) 50 50 50 混匀,Buffer B溶液(μL) 50 50 50 混匀,Buffer C溶液(μL) 50 50 50 混匀,静置5分钟,于545nm波长处读取吸光度。 - 取无内毒素离心管或PCR管,加入10μL内毒素检测用水、内毒素标准品溶液或待测样品。
- 再加入5μL内毒素检测试剂溶液,混匀,盖上铝箔纸,37℃避光孵育T1分钟。
- 孵育结束,加入10μL显色剂溶液,混匀,37℃孵育T2分钟。
- 孵育结束,加入50μL Buffer A溶液,混匀。
- 加入50μL Buffer B溶液,混匀。
- 加入50μL Buffer C溶液,混匀,静置5分钟,使用分光光度计或酶标仪在545nm波长处读取吸光度值。显色反应结束到读取吸光度值的时间不应超过5小时。
- 待测样品中内毒素含量约在0.1EU/mL~1.0EU/mL范围内时,37℃孵育时间推荐使用T1为9分钟,T2为6分钟。
- 待测样品中内毒素含量约在0.01EU/mL~0.10EU/mL范围内时,37℃孵育时间推荐使用T1为25分钟,T2为6分钟。
- T1孵育时间非绝对固定值,可根据具体实验情况,并参考如下标准进行调整:
- 待测样品的T1反应时间需与绘制标准曲线时所用T1时间一致,以保证样品中内毒素浓度的准确定量;
- 在绘制标准曲线时,如果最高浓度内毒素点吸光度值趋于饱和(如吸光度值大于1.5及以上),导致标准曲线在高浓度内毒素点之间不成线性关系,可适当缩短T1反应时间,使最高浓度内毒素点的吸光度值在0.5~1.4之间的相对合理范围内,以确保标准曲线的准确绘制,并使用相同的T1孵育时间进行待测样品内毒素含量的检测;
- 在绘制标准曲线时,如果最高浓度内毒素点吸光度值过低(如吸光度值小于0.5及以下),导致标准曲线在不同浓度内毒素点之间吸光度差异过小,可适当延长T1孵育时间以增强样品的显色效果,提高545nm波长处吸光度值的测定准确性,并使用相同的T1孵育时间进行待测样品内毒素含量的检测。T2反应时间通常无需调整。
- 待测样品的T1反应时间需与绘制标准曲线时所用T1时间一致,以保证样品中内毒素浓度的准确定量;
- 以上混匀操作均可轻晃离心管2~3次以达到混匀目的,无需漩涡振荡。
- 请务必在无内毒素的条件下,使用无内毒素的实验耗材进行内毒素检测的所有操作,以免造成试剂或样品污染,干扰实验结果。
- 若同时检测的样品数目较多,建议步骤b-c中,于冰上进行内毒素检测试剂溶液和显色剂溶液的添加,随后将所有样品统一进行37℃的T1和T2分钟孵育,以避免因加样顺序、加样时间、样品孵育时间等因素导致样品间出现检测误差。
- 取无内毒素离心管或PCR管,加入10μL内毒素检测用水、内毒素标准品溶液或待测样品。
- 内毒素标准品溶液的准备。
- 数据处理:
建立标准曲线:Y=bX+a,其中Y为545nm处吸光度值,X为内毒素的浓度,b为标准曲线斜率,a为Y轴截距。使用本制品进行显色反应的效果及标准曲线的检测效果请参考图1。当检测数据同时满足如下三个条件时获得的检测结果才有效:- 标准曲线的浓度点≥3 (相邻浓度间稀释倍数不得大于10),标准曲线的相关系数R2≥0.980。
- 标准曲线最低点的Y值大于阴性对照的Y值。
- 待测样品的吸光度值在标准曲线的区间内。
- 制作内毒素含量在0.01EU/mL~0.10EU/mL范围内的标准曲线时,阴性对照的吸光度值通常需小于0.2,0.1EU/mL的标准内毒素溶液吸光度值通常需大于0.5。
- 制作内毒素含量在0.1EU/mL~1.0EU/mL范围内的标准曲线时,阴性对照的吸光度值通常需小于0.2,1.0EU/mL的标准内毒素溶液吸光度值通常需大于0.75。
- 在绘制标准曲线时,如果最高浓度内毒素点吸光度值趋于饱和(如吸光度值大于1.5及以上),导致标准曲线在高浓度内毒素点之间不成线性关系,可适当缩短T1反应时间,使最高浓度内毒素点的吸光度值在0.5~1.4之间的相对合理范围内,以确保标准曲线的准确绘制,并使用相同的T1孵育时间进行待测样品内毒素含量的检测;如果最高浓度内毒素点吸光度值过低(如吸光度值小于0.5及以下),导致标准曲线在不同浓度内毒素点之间吸光度差异过小,可适当延长T1孵育时间以增强样品的显色效果,提高545nm波长处吸光度值的测定准确性,并使用相同的T1孵育时间进行待测样品内毒素含量检测。T2反应时间通常无需调整。
- 标准曲线的浓度点≥3 (相邻浓度间稀释倍数不得大于10),标准曲线的相关系数R2≥0.980。
- 待测样品的干扰实验:
待测样品的干扰实验详见《中华人民共和国药典》2025版中《细菌内毒素检查法》的“光度测定法干扰实验”。具体操作步骤如下:- 选择标准曲线中点或一个靠近中点的内毒素浓度(设为λm),作为待测样品干扰实验中添加的内毒素浓度,配制含浓度为λm的内毒素的待测样品作为阳性对照,测量出该溶液的内毒素浓度,称为Cs。
- 测量出未添加外源内毒素的待测样品溶液内毒素浓度,称为Ct。
- 计算该实验条件下的回收率R=(Cs-Ct)/λm×100%。
- 当R在50%~200%之间,则认为在此实验条件下待测样品溶液不存在干扰作用。
- 当R在50%~200%之外,需对待测样品进行系列稀释(稀释倍数不得超过最大有效稀释倍数MVD)或进行其它处理消除干扰,每一稀释溶液都需重复步骤a-c,直到内毒素的回收率R在50%~200%之间。选择回收率R最接近100%的稀释倍数进行待测样品内毒素含量的检测。
- MVD=cL/λ,该公式中L为待测样品的细菌内毒素限值;c为待测样品溶液的浓度,当L以EU/mg或EU/U表示时,c的单位需为mg/ml或U/ml,当L以EU/mL表示时,则c等于1.0mL/ml。如需计算在MVD时的待测样品浓度,即最小有效稀释浓度,可使用公式c=λ/L;λ为在凝胶法中鲎试剂的标示灵敏度(EU/mL)或是在光度测定法中所使用的标准曲线上最低的内毒素浓度。
- 选择标准曲线中点或一个靠近中点的内毒素浓度(设为λm),作为待测样品干扰实验中添加的内毒素浓度,配制含浓度为λm的内毒素的待测样品作为阳性对照,测量出该溶液的内毒素浓度,称为Cs。

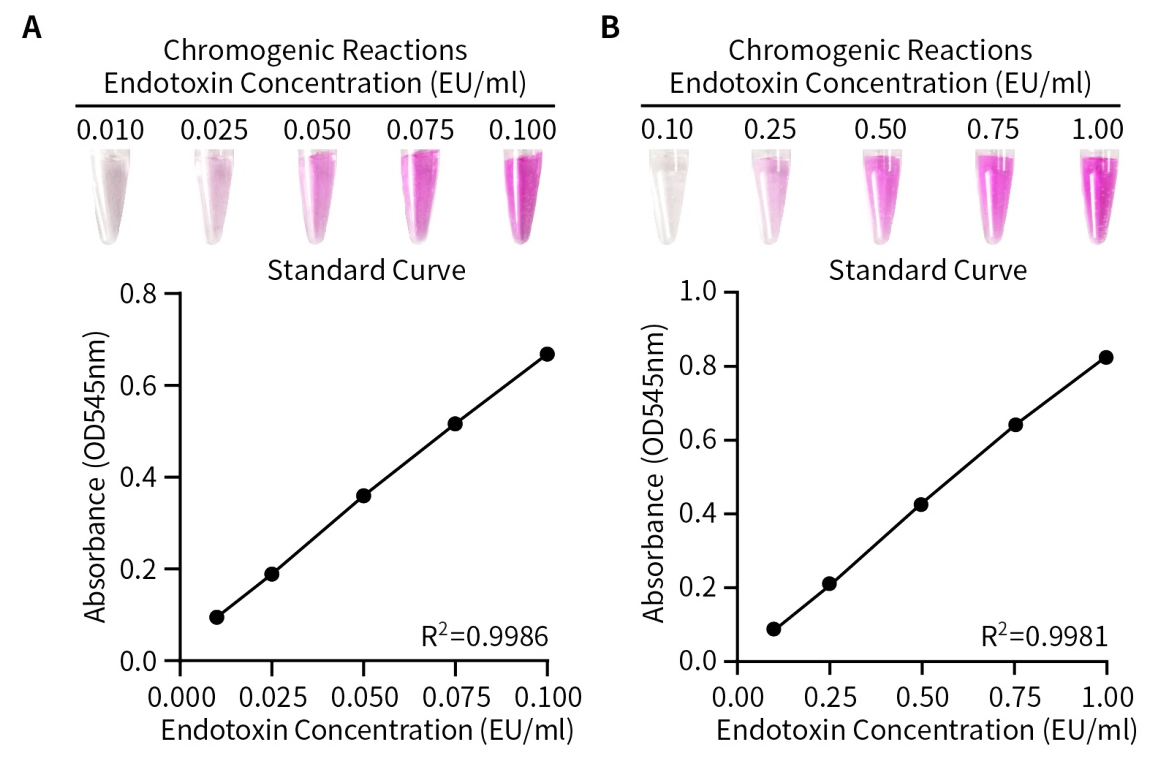
图1.细菌内毒素检测试剂盒(鲎试剂显色法改良型)检测标准曲线的效果图。取配制好的下列浓度的内毒素标准品溶液:0.000、0.010、0.025、0.050、0.075、0.100EU/mL (图A)及0.00、0.10、0.25、0.50、0.75、1.00EU/mL (图B)各10μL,用本试剂盒进行显色反应及标准曲线的检测。实际检测时会因检测仪器等实验条件的不同而存在差异,图中数据仅供参考。

- 什么原因会造成标准曲线的检测效果不好?
有以下原因会影响标准曲线的制作:- 本制品可做两条标准曲线,内毒素浓度范围分别为0.1~1.0EU/mL或者0.01~0.10EU/mL。若使用内毒素标准品配制的内毒素溶液的浓度不在此范围内,则会影响标准曲线的准确度。
- 仔细阅读说明书,确保操作步骤无误,数据计算准确!
- 确定配制的内毒素标准品溶液是否充分振荡混合均匀。推荐使用漩涡振荡器对内毒素溶液进行振荡混匀。
- 确定内毒素检测试剂是否完全溶解并混匀。且内毒素检测试剂要在10分钟内用完,否则会影响检测效果。因此需先完成内毒素标准品溶液的配制工作和待测样品的准备工作,再溶解内毒素检测试剂。同时内毒素检测试剂溶解后需轻轻混匀并静置20秒再进行使用。
- 精确控制孵育时间。多个样品同时进行检测时,每一步均要求尽快完成加样操作,并避免污染。
- 精确控制孵育温度。推荐选择水浴进行孵育。
- 本制品可做两条标准曲线,内毒素浓度范围分别为0.1~1.0EU/mL或者0.01~0.10EU/mL。若使用内毒素标准品配制的内毒素溶液的浓度不在此范围内,则会影响标准曲线的准确度。
- 如何检测内毒素含量未知的样品?
对于内毒素含量未知的样品的检测,需先做预实验大致确定样品中内毒素的浓度范围。建议先做0.1~1.0EU/mL标准曲线来确定样品内毒素浓度范围。如果检测出样品内毒素浓度超过标曲上限,则选择对样品稀释后再进行检测;若检测出样品内毒素浓度超过标曲下限,则选择制作并使用0.01~0.10EU/mL浓度范围内的标准曲线进行检测。大致确定待测样品的内毒素浓度范围,并选用合适的标准曲线后,待测样品还需做干扰实验以验证实验的可靠性,具体操作请见使用说明中的第4点待测样品的干扰实验部分或参考中国药典中的相关描述。如果检测出样品内毒素浓度超过本制品的检测范围,推荐使用具有更高检测灵敏度、更宽检测范围的系列产品进行内毒素含量检测,如高灵敏细菌内毒素检测试剂盒(鲎试剂动态浊度法)、高灵敏度细菌内毒素快速检测试剂盒(鲎试剂显色法)、高灵敏度细菌内毒素检测试剂盒(鲎试剂动态显色法)、高灵敏度细菌内毒素检测试剂盒(鲎试剂显色法改良型),具体操作请参考相应产品的使用说明进行。 - 本制品是否适用于血液样品的内毒素检测?
可以。本制品属于含偶氮化试剂显色剂的鲎试剂内毒素含量检测试剂盒,抗干扰能力强,可以用于检测血液样品中的内毒素含量。但需注意,建议使用处理后的全血样品进行内毒素含量的检测,例如:全血经抗凝处理,高速离心后获得的血浆样品;或全血经凝血处理,获得的血清样品。但建议对血浆样品先进行10倍或其它倍数的稀释(稀释倍数需根据样品中的内毒素含量及样品中抑制显色反应的成分含量进行摸索测试),随后70℃加热处理,再进行内毒素含量检测,以尽可能降低样品中个别组分对内毒素检测的影响或抑制作用。 - 能否使用酶标仪检测反应后样品的吸光度?
可以。在反应完成后,可用分光光度计检测波长545nm处的吸光度,也可吸取适当体积的显色反应后样品至GoldBalb系列平底,无色透明的96孔细胞培养板中,并使用酶标仪进行检测。如无545波长,也可选择使用540nm处波长进行检测。
相关搜索:细菌内毒素检测试剂盒(鲎试剂显色法改良型),内毒素检测,细菌脂多糖检测,细菌LPS检测,Improved Chromogenic LAL Endotoxin Assay Kit



